AMIDAS
Una amida es un compuesto orgánico cuyo grupo funcional es de tipo RCONRlRll, siendo CO el grupo funcional carbonilo, N un átomo de nitrógeno, y R, Rl, Rll radicales orgánicos o átomos de hidrógeno.
Se puede considerar como un derivado de un ácido carboxílico por sustitución de grupo oxidrilo (-OH) del ácido por un grupo –NH2, -NHR ó –NRRl llamado grupo amino.
En síntesis, se caracterizan por tener un átomo de nitrógeno con tres enlaces unido al grupo carbonilo.
Las amidas más sencillas son derivados del amoníaco.
Tipos de Amidas
Existen tres tipos de amidas conocidas como primarias, secundarias y terciarias, dependiendo del de sustitución del átomo de nitrógeno; también se les llama amidas sencillas, sustituidas o disustituidas respectivamente.

Obtención de las Amidas
Las amidas son comunes en la naturaleza y se encuentran en sustancias como los aminoácidos, las proteínas, el ADN y el ARN, hormonas y vitaminas.
Uno de los principales métodos de obtención de estos compuestos consiste en hacer reaccionar el amoniaco (o aminas primarias o secundarias) con ésteres.
Reacciones
- Las amidas se pueden convertir directamente en ésteres por reacción de los alcoholes en medio ácido
- Las amidas primarias poseen reacciones especiales:
- Se pueden deshidratar por calefacción con pentóxido de fósforo (P2O2) formando nitrilos
- Reaccionan con el ácido nitroso, formando el ácido carboxílico y nitrógeno
- Las amidas se pueden hidrolizar (romper por acción del agua)
- En conclusión, las amidas por hidrólisis ácida dan ácidos; por hidrólisis básica dan sales; con alcoholes producen ésteres; y por deshidratación producen nitrilos.
Propiedades Físicas
- A excepción de la amida más sencillas (la formamida), las amidas sencillas son todas sólidas y solubles en , sus puntos de ebullición son bastante más altos que los de los ácidos correspondientes
- Casi todas las amidas son incoloras e inodoras
- Son neutras frente a los indicadores
- Los puntos de fusión y ebullición de las amidas secundarias son bastante menores
- Por su parte, las amidas terciarias no pueden asociarse, por lo que son líquidos normales, con puntos de fusión y ebullición de acuerdo con su molecular
AMINAS
Las Aminas son compuestos que se obtienen cuando los hidrógenos del amoníaco son reemplazados o sustituidos por radicales alcohólicos o aromáticos.
Si son reemplazados por radicales alcohólicos tenemos a las aminas alifáticas. Si son sustituidos por radicales aromáticos tenemos a las aminas aromáticas.
Dentro de las aminas alifáticas tenemos a las primarias (cuando se sustituye un solo átomo de hidrógeno), las secundarias (cuando son dos los hidrógenos sustituidos) y las terciarias (aquellas en las que los tres hidrógenos son reemplazados).

En el ejemplo vemos que también podemos clasificar a las aminas alifáticas no solo en si son primarias, secundarias o terciarias sino que pueden ser simples o mixtas.
Simples son las que presentan los mismos radicales alcohólicos y mixtas las que tienen distintos radicales alcohólicos en la amina. La metil etil amina y la metil dietil amina mostradas en el ejemplo son mixtas.
En la metil amina observamos que el (-NH2) es un radical, se denomina amino. En las aminas secundarias se forma el radical imino (=NH), en este caso el nitrógeno tiene dos valencias libres en lugar de una.
Las aminas aromáticas también presentan aminas primarias, secundarias y terciarias.

Propiedades físicas:
La primera es gaseosa, hasta la de 11 carbonos son líquidas, luego sólidas.
Como siempre, el punto de ebullición aumenta con la cantidad de carbonos.
Con respecto a su solubilidad, las primeras son muy solubles en agua, luego va disminuyendo con la cantidad de átomos de carbono.
Propiedades químicas:
Combustión: Las aminas a diferencia del amoníaco arden en presencia de oxígeno por tener átomos de carbono.Poseen un leve carácter ácido en solución acuosa.Formación de sales:Las aminas al ser de carácter básico, son consideradas bases orgánicas. Por lo tanto pueden reaccionar con ácidos para formar sales. Reacción de diferenciación de las aminas:Las aminas 1°, 2° y 3° pueden reaccionar con al ácido nitroso. Esta reacción se aprovecha para poder distinguirlas.
Reacción de diferenciación de las aminas:Las aminas 1°, 2° y 3° pueden reaccionar con al ácido nitroso. Esta reacción se aprovecha para poder distinguirlas.
Propiedades químicas:
Presenta las mismas características químicas que las aminas alifáticas. Arde en presencia de la llama (combustible). Tiene un carácter básico más débil que las otras aminas.
Reacciona con el ácido sulfúrico a temperaturas elevadas.

Otro reactivo que es afín con la anilina es el ácido acético. En caliente también.
ACIDOS CARBOXILICOS
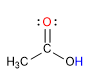
Los ácidos carboxílicos constituyen un grupo de compuestos, caracterizados porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi. En el grupo funcional carboxilo coinciden sobre el mismo carbono un grupo hidroxilo y carbonilo. Se puede representar como -COOH ó -CO2H.
Propiedades físicas de los Ácidos Carboxílicos
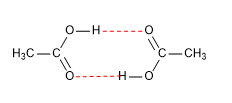
Los ácidos carboxílicos son moléculas con geometría trigonal plana. Presentan hidrógeno ácido en el grupo hidroxilo y se comportan como bases sobre el oxígeno carbonílico.
Los puntos de fusión y ebullición son elevados ya que forman dímeros, debido a los enlaces por puentes de hidrógeno.